Pengertian Stoikiometri
Stoikiometri di dalam ilmu kimia, (kadang disebut stoikiometri reaksi agar membedakannya dari stoikiometri komposisi) ialah ilmu yang mempelajari dan menghitung hubungan kuantitatif dari reaktan dan produk dalam reaksi kimia . Kata ini berasal dari bahasa Yunani stoikheion (elemen) dan metriā (ukuran).
Stoikiometri di dasarkan pada hukum dasar kimia, yaitu hukum kekekalan massa, hukum perbandingan tetap, dan hukum perbandingan berganda.
Stoikiometri gas ialah suatu bentuk khusus, di mana reaktan dan produknya seluruhnya merupakan gas. Di dalam kasus ini, koefisien zat (yang menyatakan perbandingan mol dalam stoikiometri reaksi) sekaligus menyatakan perbandingan volume antara zat-zat yang terlibat.
Dasar stoikiometri larutan
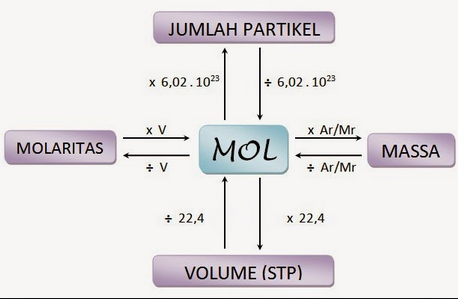
Istilah “konsentrasi” larutan ialah menyatakan jumlah zat terlarut yang dilarutkan ke dalam sejumlah tertentu pelarut ataupun sejumlah tertentu larutan. Konsentrasi larutan bisa dinyatakan dalam molaritas. Molaritas (M) didefinisikan sebagai jumlah mol zat terlarut per liter larutan
Dasar Stoikiometri Gas Ideal
Volum molar, di definisikan sebagai volum dari 1 mol entitas (atom, ion, molekul, unit formula) dari materi. Satuan dari volum molar ialah L/mol.
Jenis Stoikiometri
Stoikiometri Reaksi: Stoikiometri sering sekali digunakan untuk menyeimbangkan persamaan kimia yang dapat ditemukan pada stoikiometri reaksi. hal Ini menggambarkan hubungan kuantitatif antara zat karena berpartisipasi dalam reaksi kimia. Di dalam contoh di atas, nitrogen dan hidrogen bereaksi untuk membentuk amonia, reaksi stoikiometri menggambarkan rasio molekul nitrogen, hidrogen dan amonia 1: 3: 2.
Stoikiometri Komposisi :hal ini menjelaskan kuantitatif (massa) hubungan antara unsur-unsur dalam senyawa. contohnya, stoikiometri komposisi menggambarkan (massa) nitrogen dengan hidrogen yang bergabung menjadi amonia kompleks. yaitu 1 (satu) mol nitrogen dan 3 (tiga) mol hidrogen dalam setiap 2 mol amonia. Mol ialah satuan yang dipakai dalam kimia untuk jumlah zat.
Stoikiometri Gas: ialah Jenis stoikiometri yang berkaitan dengan reaksi yang melibatkan gas, di mana gas berada pada suhu, tekanan dan volume yang di kenal dan dianggap gas ideal. Untuk gas, perbandingan volume idealnya sama dengan hukum gas ideal,akan tetapi rasio massa reaksi tunggal harus dihitung dari massa molekul reaktan dan produk, di mana massa molekul ialah massa 1 (satu) molekul zat. Gas ideal ialahgas teoretis yang terdiri dari satu set partikel dan yang bergerak acak, tanpa-berinteraksi yang mematuhi hukum gas ideal. Hukum gas ideal ialah persamaan keadaan gas ideal. Persamaan hukum gas ideal adalah PV = nRT, di mana P adalah tekanan,dan V adalah volume dan T adalah temperatur absolut,sedangkan n adalah mol gas dan R adalah konstanta gas universal.
Rasio Stoikiometri
Sejumlah stoikiometri (rasio reagen) atau zat yang ditambahkan ke sistem dalam rangka membuat reaksi kimia ialah jumlah atau rasio di mana, dengan asumsi bahwa hasil dari reaksi selesai dengan dasar sebagai berikut:
- Tidak ada sisa-sisa residu
- Semua reagen yang dikonsumsi
- Tidak ada defisit reagen
Reaksi hanya terjadi pada rasio stoikiometri
Stoikiometri bersandar pada hukum seperti hukum perbandingan tetap, hukum perbandingan ganda dan hukum kekekalan massa.
Hukum kekekalan massa = Menggunakan hukum-hukum fisika seperti hukum kekekalan massa, yang menyatakan massa reaktan sama dengan massa produk, Stoikiometri dipakai untuk mengumpulkan informasi tentang jumlah berbagai unsur yang digunakan di dalam reaksi kimia , dan apakah mereka mengambil bentuk gas, padat atau cairan.Hukum perbandingan tetap = Ini menyatakan bahwasanya senyawa kimia (zat yang terdiri dari 2 atau lebih usnur) selalu berisi proporsi yang sama dari unsur (senyawa dengan satu jenis atom) dengan massa.
Contoh Soal Stoikiometri
Sebuah senyawa Propana terbakar dengan persamaan reaksi sebagai berikut ini :
C3H8+O2⟶H2O+CO2
Jika 200 g propana yang terbakar, maka hitunglah berapa jumlah H2O yang harusnya terbentuk?
Penyelesaian :
Setarakan persamaan reaksinya!
Hitung mol C3H8!
mol=m/Mr -> mol= 200 g/ 44 g/mol ->mol= 4.54 mol
mol=m/Mr -> mol= 200 g/ 44 g/mol ->mol= 4.54 mol
Hitung rasio H2O : C3H8 -> 4:1
Hitung mol H2O dengan perbandingan contohnya 1
mol H2O : 4 = mol C3H8 : 1
-> mol H2O : 4 = 4.54 mol : 1
-> mol H2O = 4.54 x 4= 18.18 mol
mol H2O : 4 = mol C3H8 : 1
-> mol H2O : 4 = 4.54 mol : 1
-> mol H2O = 4.54 x 4= 18.18 mol
Konversi dari mol ke gram.
mol = m/Mr
m = mol x Mr
m = 18.18 mol x 18
m = 327.27 gram
mol = m/Mr
m = mol x Mr
m = 18.18 mol x 18
m = 327.27 gram
sumber:
Pengertian Stoikiometri
Stoikiometri di dalam ilmu kimia, (kadang disebut stoikiometri reaksi agar membedakannya dari stoikiometri komposisi) ialah ilmu yang mempelajari dan menghitung hubungan kuantitatif dari reaktan dan produk dalam reaksi kimia . Kata ini berasal dari bahasa Yunani stoikheion (elemen) dan metriā (ukuran).
Stoikiometri di dasarkan pada hukum dasar kimia, yaitu hukum kekekalan massa, hukum perbandingan tetap, dan hukum perbandingan berganda.
Stoikiometri gas ialah suatu bentuk khusus, di mana reaktan dan produknya seluruhnya merupakan gas. Di dalam kasus ini, koefisien zat (yang menyatakan perbandingan mol dalam stoikiometri reaksi) sekaligus menyatakan perbandingan volume antara zat-zat yang terlibat.
Dasar stoikiometri larutan
Istilah “konsentrasi” larutan ialah menyatakan jumlah zat terlarut yang dilarutkan ke dalam sejumlah tertentu pelarut ataupun sejumlah tertentu larutan. Konsentrasi larutan bisa dinyatakan dalam molaritas. Molaritas (M) didefinisikan sebagai jumlah mol zat terlarut per liter larutan
Dasar Stoikiometri Gas Ideal
Volum molar, di definisikan sebagai volum dari 1 mol entitas (atom, ion, molekul, unit formula) dari materi. Satuan dari volum molar ialah L/mol.

Jenis Stoikiometri
Stoikiometri Reaksi: Stoikiometri sering sekali digunakan untuk menyeimbangkan persamaan kimia yang dapat ditemukan pada stoikiometri reaksi. hal Ini menggambarkan hubungan kuantitatif antara zat karena berpartisipasi dalam reaksi kimia. Di dalam contoh di atas, nitrogen dan hidrogen bereaksi untuk membentuk amonia, reaksi stoikiometri menggambarkan rasio molekul nitrogen, hidrogen dan amonia 1: 3: 2.
Stoikiometri Komposisi :hal ini menjelaskan kuantitatif (massa) hubungan antara unsur-unsur dalam senyawa. contohnya, stoikiometri komposisi menggambarkan (massa) nitrogen dengan hidrogen yang bergabung menjadi amonia kompleks. yaitu 1 (satu) mol nitrogen dan 3 (tiga) mol hidrogen dalam setiap 2 mol amonia. Mol ialah satuan yang dipakai dalam kimia untuk jumlah zat.
Stoikiometri Gas: ialah Jenis stoikiometri yang berkaitan dengan reaksi yang melibatkan gas, di mana gas berada pada suhu, tekanan dan volume yang di kenal dan dianggap gas ideal. Untuk gas, perbandingan volume idealnya sama dengan hukum gas ideal,akan tetapi rasio massa reaksi tunggal harus dihitung dari massa molekul reaktan dan produk, di mana massa molekul ialah massa 1 (satu) molekul zat. Gas ideal ialahgas teoretis yang terdiri dari satu set partikel dan yang bergerak acak, tanpa-berinteraksi yang mematuhi hukum gas ideal. Hukum gas ideal ialah persamaan keadaan gas ideal. Persamaan hukum gas ideal adalah PV = nRT, di mana P adalah tekanan,dan V adalah volume dan T adalah temperatur absolut,sedangkan n adalah mol gas dan R adalah konstanta gas universal.
Rasio Stoikiometri
Sejumlah stoikiometri (rasio reagen) atau zat yang ditambahkan ke sistem dalam rangka membuat reaksi kimia ialah jumlah atau rasio di mana, dengan asumsi bahwa hasil dari reaksi selesai dengan dasar sebagai berikut:
- Tidak ada sisa-sisa residu
- Semua reagen yang dikonsumsi
- Tidak ada defisit reagen
Reaksi hanya terjadi pada rasio stoikiometri
Stoikiometri bersandar pada hukum seperti hukum perbandingan tetap, hukum perbandingan ganda dan hukum kekekalan massa.
Hukum kekekalan massa = Menggunakan hukum-hukum fisika seperti hukum kekekalan massa, yang menyatakan massa reaktan sama dengan massa produk, Stoikiometri dipakai untuk mengumpulkan informasi tentang jumlah berbagai unsur yang digunakan di dalam reaksi kimia , dan apakah mereka mengambil bentuk gas, padat atau cairan.Hukum perbandingan tetap = Ini menyatakan bahwasanya senyawa kimia (zat yang terdiri dari 2 atau lebih usnur) selalu berisi proporsi yang sama dari unsur (senyawa dengan satu jenis atom) dengan massa.
Contoh Soal Stoikiometri
Sebuah senyawa Propana terbakar dengan persamaan reaksi sebagai berikut ini :
C3H8+O2⟶H2O+CO2
Jika 200 g propana yang terbakar, maka hitunglah berapa jumlah H2O yang harusnya terbentuk?
Penyelesaian :
Setarakan persamaan reaksinya!
Hitung mol C3H8!
mol=m/Mr -> mol= 200 g/ 44 g/mol ->mol= 4.54 mol
mol=m/Mr -> mol= 200 g/ 44 g/mol ->mol= 4.54 mol
Hitung rasio H2O : C3H8 -> 4:1
Hitung mol H2O dengan perbandingan contohnya 1
mol H2O : 4 = mol C3H8 : 1
-> mol H2O : 4 = 4.54 mol : 1
-> mol H2O = 4.54 x 4= 18.18 mol
mol H2O : 4 = mol C3H8 : 1
-> mol H2O : 4 = 4.54 mol : 1
-> mol H2O = 4.54 x 4= 18.18 mol
Konversi dari mol ke gram.
mol = m/Mr
m = mol x Mr
m = 18.18 mol x 18
m = 327.27 gram
mol = m/Mr
m = mol x Mr
m = 18.18 mol x 18
m = 327.27 gram
Pengertian Stoikiometri
Stoikiometri di dalam ilmu kimia, (kadang disebut stoikiometri reaksi agar membedakannya dari stoikiometri komposisi) ialah ilmu yang mempelajari dan menghitung hubungan kuantitatif dari reaktan dan produk dalam reaksi kimia . Kata ini berasal dari bahasa Yunani stoikheion (elemen) dan metriā (ukuran).
Stoikiometri di dasarkan pada hukum dasar kimia, yaitu hukum kekekalan massa, hukum perbandingan tetap, dan hukum perbandingan berganda.
Stoikiometri gas ialah suatu bentuk khusus, di mana reaktan dan produknya seluruhnya merupakan gas. Di dalam kasus ini, koefisien zat (yang menyatakan perbandingan mol dalam stoikiometri reaksi) sekaligus menyatakan perbandingan volume antara zat-zat yang terlibat.
Dasar stoikiometri larutan
Istilah “konsentrasi” larutan ialah menyatakan jumlah zat terlarut yang dilarutkan ke dalam sejumlah tertentu pelarut ataupun sejumlah tertentu larutan. Konsentrasi larutan bisa dinyatakan dalam molaritas. Molaritas (M) didefinisikan sebagai jumlah mol zat terlarut per liter larutan
Dasar Stoikiometri Gas Ideal
Volum molar, di definisikan sebagai volum dari 1 mol entitas (atom, ion, molekul, unit formula) dari materi. Satuan dari volum molar ialah L/mol.

Jenis Stoikiometri
Stoikiometri Reaksi: Stoikiometri sering sekali digunakan untuk menyeimbangkan persamaan kimia yang dapat ditemukan pada stoikiometri reaksi. hal Ini menggambarkan hubungan kuantitatif antara zat karena berpartisipasi dalam reaksi kimia. Di dalam contoh di atas, nitrogen dan hidrogen bereaksi untuk membentuk amonia, reaksi stoikiometri menggambarkan rasio molekul nitrogen, hidrogen dan amonia 1: 3: 2.
Stoikiometri Komposisi :hal ini menjelaskan kuantitatif (massa) hubungan antara unsur-unsur dalam senyawa. contohnya, stoikiometri komposisi menggambarkan (massa) nitrogen dengan hidrogen yang bergabung menjadi amonia kompleks. yaitu 1 (satu) mol nitrogen dan 3 (tiga) mol hidrogen dalam setiap 2 mol amonia. Mol ialah satuan yang dipakai dalam kimia untuk jumlah zat.
Stoikiometri Gas: ialah Jenis stoikiometri yang berkaitan dengan reaksi yang melibatkan gas, di mana gas berada pada suhu, tekanan dan volume yang di kenal dan dianggap gas ideal. Untuk gas, perbandingan volume idealnya sama dengan hukum gas ideal,akan tetapi rasio massa reaksi tunggal harus dihitung dari massa molekul reaktan dan produk, di mana massa molekul ialah massa 1 (satu) molekul zat. Gas ideal ialahgas teoretis yang terdiri dari satu set partikel dan yang bergerak acak, tanpa-berinteraksi yang mematuhi hukum gas ideal. Hukum gas ideal ialah persamaan keadaan gas ideal. Persamaan hukum gas ideal adalah PV = nRT, di mana P adalah tekanan,dan V adalah volume dan T adalah temperatur absolut,sedangkan n adalah mol gas dan R adalah konstanta gas universal.
Rasio Stoikiometri
Sejumlah stoikiometri (rasio reagen) atau zat yang ditambahkan ke sistem dalam rangka membuat reaksi kimia ialah jumlah atau rasio di mana, dengan asumsi bahwa hasil dari reaksi selesai dengan dasar sebagai berikut:
- Tidak ada sisa-sisa residu
- Semua reagen yang dikonsumsi
- Tidak ada defisit reagen
Reaksi hanya terjadi pada rasio stoikiometri
Stoikiometri bersandar pada hukum seperti hukum perbandingan tetap, hukum perbandingan ganda dan hukum kekekalan massa.
Hukum kekekalan massa = Menggunakan hukum-hukum fisika seperti hukum kekekalan massa, yang menyatakan massa reaktan sama dengan massa produk, Stoikiometri dipakai untuk mengumpulkan informasi tentang jumlah berbagai unsur yang digunakan di dalam reaksi kimia , dan apakah mereka mengambil bentuk gas, padat atau cairan.Hukum perbandingan tetap = Ini menyatakan bahwasanya senyawa kimia (zat yang terdiri dari 2 atau lebih usnur) selalu berisi proporsi yang sama dari unsur (senyawa dengan satu jenis atom) dengan massa.
Contoh Soal Stoikiometri
Sebuah senyawa Propana terbakar dengan persamaan reaksi sebagai berikut ini :
C3H8+O2⟶H2O+CO2
Jika 200 g propana yang terbakar, maka hitunglah berapa jumlah H2O yang harusnya terbentuk?
Penyelesaian :
Setarakan persamaan reaksinya!
Hitung mol C3H8!
mol=m/Mr -> mol= 200 g/ 44 g/mol ->mol= 4.54 mol
mol=m/Mr -> mol= 200 g/ 44 g/mol ->mol= 4.54 mol
Hitung rasio H2O : C3H8 -> 4:1
Hitung mol H2O dengan perbandingan contohnya 1
mol H2O : 4 = mol C3H8 : 1
-> mol H2O : 4 = 4.54 mol : 1
-> mol H2O = 4.54 x 4= 18.18 mol
mol H2O : 4 = mol C3H8 : 1
-> mol H2O : 4 = 4.54 mol : 1
-> mol H2O = 4.54 x 4= 18.18 mol
Konversi dari mol ke gram.
mol = m/Mr
m = mol x Mr
m = 18.18 mol x 18
m = 327.27 gram
mol = m/Mr
m = mol x Mr
m = 18.18 mol x 18
m = 327.27 gram








0 komentar:
Posting Komentar